輸注產(chǎn)品針刺傷防護(hù)裝置要求與評(píng)價(jià)技術(shù)審查指導(dǎo)原則
一、前言
全球范圍內(nèi)因不安全輸注所致醫(yī)護(hù)人員職業(yè)暴露及感染問題一直存在���。安全輸注是阻斷感染傳播�����、保障患者安全及醫(yī)務(wù)人員職業(yè)安全的基本路徑和有效措施��。安全輸注指對(duì)接受輸注者無害���,對(duì)實(shí)施輸注的醫(yī)護(hù)人員不帶來任何可避免的危險(xiǎn),廢棄物不對(duì)社會(huì)造成危害��。
近年來����,隨著安全防護(hù)意識(shí)增強(qiáng)以及技術(shù)手段和臨床醫(yī)療探索研究不斷發(fā)展��,針刺傷防護(hù)裝置被整合為輸注類器械產(chǎn)品(如注射針�、輸液針����、靜脈留置針等)的組件,為安全輸注提供了新的實(shí)現(xiàn)路徑與方法�。為規(guī)范和指導(dǎo)輸注類產(chǎn)品針刺傷防護(hù)裝置的要求與評(píng)價(jià),制定本指導(dǎo)原則��。
由于輸注類產(chǎn)品針刺傷防護(hù)裝置設(shè)計(jì)差異性較大且發(fā)展迅速��,本原則主要基于目前的認(rèn)知��,提出涉及針刺傷防護(hù)裝置安全��、有效�����、質(zhì)量可控的要求及評(píng)價(jià)內(nèi)容��。此外,由于針刺傷防護(hù)裝置僅為輸注產(chǎn)品的組件�,注冊(cè)申請(qǐng)人需根據(jù)產(chǎn)品自身特點(diǎn),參考本指導(dǎo)原則和輸注類產(chǎn)品強(qiáng)制性標(biāo)準(zhǔn)等技術(shù)文件撰寫產(chǎn)品注冊(cè)申報(bào)技術(shù)資料���。
二���、范圍
本指導(dǎo)原則旨在規(guī)范和指導(dǎo)輸注類產(chǎn)品針刺傷防護(hù)裝置的要求與評(píng)價(jià)。針刺傷防護(hù)裝置是指按醫(yī)療器械預(yù)期用途使用時(shí)�����,可主動(dòng)或被動(dòng)激活的防護(hù)組件���,旨在預(yù)防或減少因意外針刺傷而導(dǎo)致的疾病傳播。
用于采集動(dòng)靜脈血樣的采血針�����,其針刺傷防護(hù)裝置要求與評(píng)價(jià)可參考本指導(dǎo)原則�。
本指導(dǎo)原則不包括無針注射系統(tǒng)、銳器處理盒�����、自毀型注射器等其他安全輸注相關(guān)器械�����。
三、器械描述
注冊(cè)申請(qǐng)人應(yīng)通過產(chǎn)品標(biāo)識(shí)或隨附文件等信息闡明防護(hù)裝置的類型�����。應(yīng)有圖示直觀顯示針刺傷防護(hù)裝置在防護(hù)前及防護(hù)后的不同狀態(tài)��。建議首次上市產(chǎn)品以列表形式比較本產(chǎn)品與已上市具有針刺傷防護(hù)功能器械的異同之處���,比較內(nèi)容包括:適用范圍��、設(shè)計(jì)特征��、材質(zhì)����、規(guī)格和尺寸�����、防護(hù)機(jī)制及工作原理等����。應(yīng)著重闡述差異部分對(duì)產(chǎn)品針刺傷防護(hù)功能的影響���。
作為輸注類醫(yī)療器械產(chǎn)品的組件,在設(shè)計(jì)時(shí)應(yīng)考慮針刺傷防護(hù)裝置的引入是否會(huì)影響產(chǎn)品的主體功能�,因此在描述物理性能時(shí),建議針對(duì)以下參數(shù)與無防護(hù)裝置的產(chǎn)品進(jìn)行比較:
對(duì)主體功能可能有影響的結(jié)構(gòu)幾何尺寸
防護(hù)裝置與針管/針尖的配合
預(yù)充容量(若適用)
注射輸液港或注射器中的殘留容量
安全結(jié)構(gòu)強(qiáng)度(例如拉伸�����、彎曲��、伸長(zhǎng)等)
接頭�、粘接處等的強(qiáng)度
任何可能影響使用的透明度不良(例如回血或針插入皮膚的可視性)
標(biāo)記和刻度:顏色、刻度類型�����、指示是否可以在所有使用條件下讀取刻度(例如預(yù)充式注射器���,針尖護(hù)套在使用前縮回時(shí))
? 器械任何其他獨(dú)特的物理特性和規(guī)格。
四����、安全防護(hù)裝置的要求
安全防護(hù)裝置按照防護(hù)原理分為主動(dòng)安全性裝置和被動(dòng)安全性裝置。主動(dòng)安全性裝置是指使用者需要執(zhí)行額外步驟才能激活針刺傷防護(hù)功能,與執(zhí)行器械主要預(yù)期功能所需的任何操作分開執(zhí)行����。被動(dòng)安全性裝置是指使用者無需執(zhí)行額外步驟即可激活針刺傷防護(hù)功能。
(一)通用要求
1.在預(yù)期使用條件下���,一旦處于安全模式�,器械的安全功能應(yīng)提供對(duì)意外針刺傷的防護(hù)���,直至安全完成廢棄處置��。
2.應(yīng)使使用者能明顯知曉器械何時(shí)處于安全模式�。
安全模式激活的信息應(yīng)通過視覺�、觸覺和/或聽覺手段清晰無誤地傳達(dá)給使用者。
3.應(yīng)基于風(fēng)險(xiǎn)評(píng)估確定適當(dāng)?shù)募せ盍Α?/span>
可通過使用患者替代品(例如教學(xué)模型)模擬實(shí)際臨床使用提供支持���。研究設(shè)計(jì)應(yīng)當(dāng)基于統(tǒng)計(jì)學(xué)考慮����,并應(yīng)有明確的接受標(biāo)準(zhǔn)���。
4.針刺傷防護(hù)裝置激活后使用者的手或其他部位與針尖保持一定的距離或有效的物理隔離����。安全功能可以主動(dòng)或被動(dòng)地操作。如果需要主動(dòng)激活���,建議單手操作��。
5.防護(hù)裝置的安全性能不應(yīng)妨礙或影響器械預(yù)期的臨床使用性能�;在預(yù)期使用條件下應(yīng)能防止意外激活�;對(duì)正常使用后的處理不產(chǎn)生負(fù)面影響。
上述性能應(yīng)通過在指定使用條件下進(jìn)行適當(dāng)?shù)哪M或者臨床使用研究來證明�����。
(二)防護(hù)裝置的激活
1.主動(dòng)刺傷防護(hù)功能應(yīng)能在按預(yù)期使用后即刻激活�。
2.被動(dòng)刺傷防護(hù)功能應(yīng)在按預(yù)期使用后即刻進(jìn)入安全模式。
3.針刺傷防護(hù)裝置應(yīng)確保器械能實(shí)現(xiàn)預(yù)期使用功能���,應(yīng)保證激活方便并且可避免意外激活。
建議注冊(cè)申請(qǐng)人基于風(fēng)險(xiǎn)評(píng)估方法確定申報(bào)產(chǎn)品激活刺傷防護(hù)功能的力值�。
(三)防護(hù)裝置的安全性
1.一旦進(jìn)入安全模式,該防護(hù)裝置必須對(duì)針尖意外暴露有足夠的抵抗力����,并且能將意外接觸針尖的風(fēng)險(xiǎn)降至最低�。
2.注冊(cè)申請(qǐng)人應(yīng)基于風(fēng)險(xiǎn)評(píng)估的方法��,確定防護(hù)裝置失效的最小力值���。
(四)其他
建議通過與已上市類似功能器械進(jìn)行對(duì)比���,模擬最惡劣情況進(jìn)行評(píng)估,并描述如何確定所使用的最惡劣情況���。測(cè)試評(píng)估包括但不限于以下內(nèi)容:
安全裝置連接處的連接力和/或分離力
激活和破壞安全功能的力
由激活機(jī)制產(chǎn)生的反作用力(例如所含的彈性組件)
防護(hù)裝置的抗穿刺性
模擬極端壓力的防護(hù)裝置性能(例如向活塞施加最大力或通過輸液接口的最大流量)
輸注劑量的準(zhǔn)確性
老化前和老化后的防護(hù)功能
五���、安全防護(hù)裝置的評(píng)價(jià)
安全防護(hù)裝置的評(píng)價(jià)應(yīng)能說明一旦器械處于安全模式,會(huì)將意外接觸針尖的風(fēng)險(xiǎn)降至最低��。
(一)安全模式下的接觸測(cè)試
基于工程制造針刺傷防護(hù)器械的個(gè)性化設(shè)計(jì)����,應(yīng)通過特定的測(cè)試方法和/或通過工程研究/計(jì)算機(jī)輔助設(shè)計(jì)分析證明此類意外接觸的風(fēng)險(xiǎn)得到了最大程度降低。
應(yīng)考慮可用性工程(針對(duì)醫(yī)療器械)因素��,以評(píng)估并降低在正確使用和錯(cuò)誤使用的情況下相關(guān)可用性問題所造成的風(fēng)險(xiǎn)����。
以下測(cè)試方法可用于測(cè)試在安全模式下意外接觸的風(fēng)險(xiǎn)�。
半徑為6毫米(模擬指尖)球體在靠近激活后器械的安全功能裝置時(shí)不應(yīng)接觸針尖或銳器的末端����。對(duì)于具有貫穿管腔的鈍化安全功能的帶針器械,當(dāng)球體位于延伸的鈍化功能裝置前方并與其成一條線時(shí)����,球體不應(yīng)接觸針尖。
也可以通過工程研究/計(jì)算機(jī)分析代替上述目視檢驗(yàn)來證明對(duì)針尖的接觸情況����。
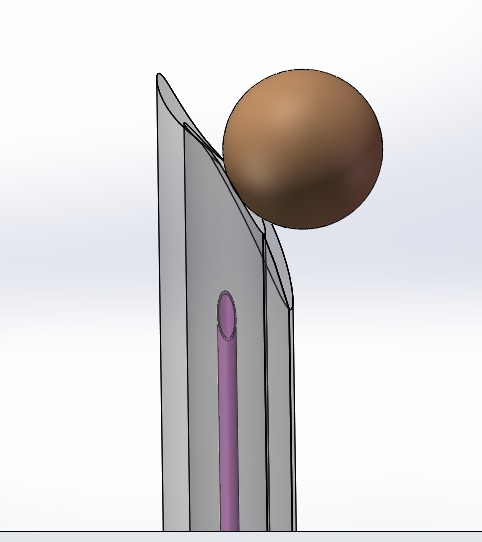
圖1 指尖模擬移動(dòng)圖示
根據(jù)器械的預(yù)期用途、環(huán)境背景和用戶概況���,也可以考慮使用根據(jù)風(fēng)險(xiǎn)評(píng)定確定的不同半徑的球體���。
(二)模擬臨床使用測(cè)試
對(duì)于包含針刺傷防護(hù)功能的器械,建議進(jìn)行模擬臨床使用測(cè)試�����,并提供對(duì)模擬臨床使用測(cè)試結(jié)果的分析以及結(jié)果和結(jié)論的總結(jié)��。模擬使用測(cè)試通過使用患者替代品(例如教學(xué)模型)來模擬實(shí)際臨床使用�。模擬使用測(cè)試有助于排除器械問題、優(yōu)化器械設(shè)計(jì)�����、識(shí)別標(biāo)簽標(biāo)識(shí)的缺陷���、評(píng)估器械使用者所需的培訓(xùn)類型�。
建議制定一個(gè)針對(duì)該類器械的特定方案�����。方案應(yīng)當(dāng)基于統(tǒng)計(jì)學(xué)考慮��,例如樣本量��、因變量���,通過/未通過標(biāo)準(zhǔn)�����,綜合報(bào)告表格/問卷�����,適當(dāng)控制和適當(dāng)?shù)慕y(tǒng)計(jì)測(cè)試方法��。該方案應(yīng)有明確的評(píng)價(jià)目標(biāo)及評(píng)價(jià)參數(shù)���、明確樣本量的確定依據(jù)��、評(píng)價(jià)人員的選擇及數(shù)量����、并闡明數(shù)據(jù)分析方法����。
1.研究設(shè)計(jì)
評(píng)價(jià)人員應(yīng)當(dāng)包括常規(guī)使用所評(píng)價(jià)器械的醫(yī)療專業(yè)人員。專業(yè)人員進(jìn)行的模擬臨床使用評(píng)價(jià)有助于避免學(xué)習(xí)曲線偽差����。建議通過選擇足夠數(shù)量的評(píng)價(jià)人員,且每位使用足量的器械樣品(例如每位評(píng)價(jià)人員使用樣品總量的1/8)����,以便于最大程度減少偏倚。在多個(gè)測(cè)試地點(diǎn)進(jìn)行的研究將減少測(cè)試偏倚����。
器械應(yīng)當(dāng)在模擬關(guān)鍵臨床變量的條件下進(jìn)行測(cè)試(例如�����,模擬患者的模型、模擬臨床實(shí)際操作流程)�。
2.評(píng)價(jià)人員培訓(xùn)
建議根據(jù)研究方案為評(píng)價(jià)人員提供培訓(xùn),以確保操作的一致性��,對(duì)通用預(yù)防措施遵守情況的模擬���,觀察����、評(píng)分和評(píng)價(jià)的一致性���,以及數(shù)據(jù)收集的完整性�。
3.報(bào)告表格
評(píng)價(jià)人員應(yīng)當(dāng)在報(bào)告表格(即評(píng)價(jià)人員問卷)上記錄測(cè)試結(jié)果���。建議記錄以下內(nèi)容:
(1)評(píng)價(jià)人員的特征和經(jīng)驗(yàn)(例如���,左手操作或右手操作、根據(jù)規(guī)定量表衡量的手的大小、性別�����、年齡�����、使用的類似器械的數(shù)量/天數(shù)����,工作環(huán)境)。
(2)評(píng)價(jià)人員使用器械的數(shù)量和類型���。
(3)執(zhí)行器械的預(yù)期功能�,例如注射���、輸注液體���。
(4)觀察重要使用性能指標(biāo),例如刻度�、回血。
(5)常規(guī)操作的任何必要變化�,例如單手使用的改變。
(6)包裝設(shè)計(jì)保證器械在使用前保持無菌的能力。
(7)激活安全功能的難易度���,以及對(duì)非預(yù)期激活的防護(hù)情況�����。
(8)遇到的所有不良反應(yīng)或問題,例如針刺傷����、安全功能未能保持激活狀態(tài)、管路斷開等��。
(9)與已上市對(duì)照器械相比����,使用防護(hù)裝置所需的時(shí)間以及對(duì)用戶接受度的影響。
(10)發(fā)現(xiàn)安全功能激活情況的能力���,以及對(duì)在實(shí)際臨床使用過程中可能遇到的與檢測(cè)相關(guān)問題的意見��。
(11)對(duì)使用器械的學(xué)習(xí)曲線(難易程度)的看法�����。
(12)對(duì)器械可接受性的評(píng)估���。
(13)其他意見���。
應(yīng)報(bào)告所有數(shù)據(jù),包括任何未通過的測(cè)試�。如果測(cè)試中出現(xiàn)了不合格,建議提供此不合格項(xiàng)的詳細(xì)說明以及為確保不合格項(xiàng)得到糾正所采取的措施���。
4.樣本量確定
樣本量可以基于在“N”件器械的測(cè)試運(yùn)行中觀察到的不合格率的置信區(qū)間�?�!安缓细瘛钡亩x為針刺傷防護(hù)失效�。置信區(qū)間上限可作為器械的“真實(shí)”不合格率的最壞情況近似值。
建議使用國際公認(rèn)的適當(dāng)統(tǒng)計(jì)軟件��。例如使用STAT EXACT TURBO生成的以下表格列出了基于不同件數(shù)器械測(cè)試樣品中觀察到0件����、1件、2件或3件不合格項(xiàng)二項(xiàng)分布獲得的95%和99%置信區(qū)間上限�����。
95%置信區(qū)間上限
| 測(cè)試器械數(shù)量 |
不合格數(shù) | 100 | 200 | 500 | 1000 |
0 | 3.6% | 1.8% | 0.7% | 0.3% |
1 | 5.4% | 2.7% | 1.1% | 0.6% |
2 | 6.9% | 3.5% | 1.4% | 0.7% |
3 | 8.3% | 4.3% | 1.7% | 0.9% |
99%置信區(qū)間上限
| 測(cè)試器械數(shù)量 |
不合格數(shù) | 100 | 200 | 500 | 1000 |
0 | 5.2% | 2.6% | 1.1% | 0.5% |
1 | 7.1% | 3.6% | 1.5% | 0.7% |
2 | 8.8% | 4.5% | 1.8% | 0.9% |
3 | 10.3% | 5.3% | 2.2% | 1.1% |
由于置信區(qū)間通常同時(shí)涉及上限和下限,因此當(dāng)僅處理一個(gè)限值時(shí)����,95%和99%的實(shí)際置信水平分別變?yōu)?7.5%和99.5%。
該模型顯示���,即使沒有報(bào)告任何不合格�����,樣本量較小也會(huì)增加接受具有潛在較高傷害率的器械的可能性。因此建議該模擬臨床使用測(cè)試包括足夠數(shù)量的器械�,以提供對(duì)器械防護(hù)性能的置信度。一般認(rèn)為測(cè)試500件器械可以檢測(cè)到1%水平的嚴(yán)重缺陷器械���。
樣本量為500時(shí)��,防護(hù)功能的不合格數(shù)應(yīng)為零����。由于根據(jù)上述置信區(qū)間將終點(diǎn)預(yù)先確定為0%的傷害率����,因此不需要測(cè)試對(duì)照器械來比較針刺傷終點(diǎn)�����。
如果提出的替代方法有充分的科學(xué)依據(jù)支持���,可考慮確定樣本量的替代方法。
六�����、風(fēng)險(xiǎn)管理
按照YY/T 0316-2016《醫(yī)療器械風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用》標(biāo)準(zhǔn)要求�,對(duì)產(chǎn)品生命周期全過程實(shí)施風(fēng)險(xiǎn)管理。評(píng)價(jià)應(yīng)至少確保:風(fēng)險(xiǎn)管理計(jì)劃已被適當(dāng)?shù)貙?shí)施����;綜合剩余風(fēng)險(xiǎn)是可接受的;已有適當(dāng)方法獲得相關(guān)生產(chǎn)和生產(chǎn)后信息�����。評(píng)價(jià)結(jié)果應(yīng)形成風(fēng)險(xiǎn)管理報(bào)告����。
已識(shí)別針刺傷防護(hù)裝置的風(fēng)險(xiǎn)應(yīng)至少考慮以下方面:
風(fēng)險(xiǎn)類別 | 具體示例 |
設(shè)計(jì)不當(dāng)及生產(chǎn)環(huán)節(jié)風(fēng)險(xiǎn) | 不能正確激活防護(hù)裝置; 用戶不能很容易判斷是否已激活針刺傷防護(hù)功能����; 針尖護(hù)套未能完全封閉針尖��; 針尖未能完全縮回至器械外殼內(nèi)�����; 外殼雖超出針頭��,但未能防止手指進(jìn)入��; 未能在廢棄處置之前一直保持防護(hù)功能�����; 標(biāo)簽未能區(qū)分防護(hù)裝置��; 影響產(chǎn)品預(yù)期使用; 零部件加工精度不當(dāng)�����; 裝配不當(dāng)�。 |
運(yùn)輸和儲(chǔ)存風(fēng)險(xiǎn) | 不恰當(dāng)?shù)陌b;污染���;運(yùn)輸中防護(hù)裝置脫位/脫落/激發(fā)��;器身損壞��;儲(chǔ)存環(huán)境不當(dāng)���。 |
使用風(fēng)險(xiǎn) | 說明書中應(yīng)明示產(chǎn)品應(yīng)由經(jīng)培訓(xùn)的專業(yè)人員使用��; 包裝標(biāo)記不當(dāng)�����,如會(huì)產(chǎn)生重復(fù)使用的危害����,引起交叉感染����; 對(duì)一次性使用的醫(yī)療器械很可能再次使用的危害警告不適當(dāng),造成重復(fù)使用�; 使用方法說明不當(dāng),造成操作錯(cuò)誤�����; 使用者未按規(guī)范程序使用。 |
可通過產(chǎn)品設(shè)計(jì)控制���、產(chǎn)品原材料選擇�����、生產(chǎn)工藝過程控制��、產(chǎn)品技術(shù)性能指標(biāo)的制定�、模擬實(shí)驗(yàn)�����、臨床試驗(yàn)�����、說明書�����、正確的標(biāo)簽標(biāo)識(shí)等多項(xiàng)措施對(duì)風(fēng)險(xiǎn)進(jìn)行控制����,以降低風(fēng)險(xiǎn)至可接受水平。
七�、說明書及標(biāo)簽
具有針刺傷防護(hù)裝置的器械應(yīng)隨附正確使用器械所需的信息,同時(shí)考慮使用者的培訓(xùn)�����,以及識(shí)別制造商所需的信息�����。
安全使用帶有針刺傷防護(hù)裝置的器械所需信息應(yīng)在每件器械的包裝上�����,或在銷售包裝上列出����。如不能在每件器械的單個(gè)包裝上注明信息,則應(yīng)在說明書中注明有關(guān)信息����。
使用說明書至少應(yīng)包含以下信息:
清楚描述如何激活防護(hù)裝置;
應(yīng)采取的預(yù)防措施或警告事項(xiàng)����;
處置針刺傷防護(hù)器械的說明����。
八���、參考資料
1.Guidance for Industry and FDA Staff Medical Devices with Sharps Injury Prevention Features. 2005.
2.ISO 23908:2011 Sharps injury protection -- Requirements and test methods -- Sharps protection features for single-use hypodermic needles, introducers for catheters and needles used for blood sampling.
3.Workbook for Designing, Implementing and Evaluating a Sharps Injury Prevention Program. CDC 2008.
九����、編寫單位
本指導(dǎo)原則由國家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心編寫并負(fù)責(zé)解釋��。