浙江省藥監(jiān)局公開發(fā)布的數(shù)據(jù),浙江省藥監(jiān)局2022年12月共收到5項創(chuàng)新醫(yī)療器械特別審查申請��,但是最終批準0項�����。國家鼓勵醫(yī)療器械創(chuàng)新�,政府各個層級都出臺了多個創(chuàng)新醫(yī)療器械鼓勵政策��,什么樣的醫(yī)療器械算是創(chuàng)新醫(yī)療器械呢����,申請申請創(chuàng)新醫(yī)療器械有什么要求�。
浙江省藥監(jiān)局公開發(fā)布的數(shù)據(jù),浙江省藥監(jiān)局2022年12月共收到5項創(chuàng)新醫(yī)療器械特別審查申請,但是最終批準0項�。國家鼓勵醫(yī)療器械創(chuàng)新��,政府各個層級都出臺了多個創(chuàng)新醫(yī)療器械鼓勵政策��,什么樣的醫(yī)療器械算是創(chuàng)新醫(yī)療器械呢�����,申請申請創(chuàng)新醫(yī)療器械有什么要求�����。

一�、2022年12月,浙江省藥監(jiān)局批準創(chuàng)新醫(yī)療器械特別審查申請0項
浙江省藥監(jiān)局發(fā)布“2022年12月審評工作情況”�,公開了2022年11月21日至12月20日注冊審評及創(chuàng)新醫(yī)療器械特別審查申請、批準工作情況����,其中,浙江省藥監(jiān)局12月批準創(chuàng)新醫(yī)療器械特別審查申請0項���,如下圖所示:
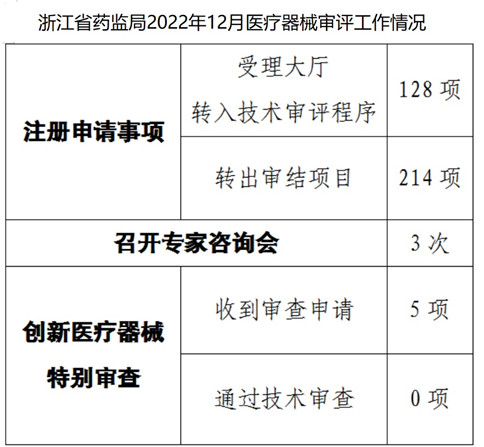
從以上創(chuàng)新醫(yī)療器械申請及批準情況���,大家也能看到創(chuàng)新醫(yī)療器械特別審查及其審批必須符合一定的條件和要求。
二、浙江省申請創(chuàng)新醫(yī)療器械有什么要求����?
1.申請人經(jīng)過其技術(shù)創(chuàng)新活動,在中國依法擁有產(chǎn)品核心技術(shù)發(fā)明專利權(quán)���,或者依法通過受讓取得在中國發(fā)明專利權(quán)或其使用權(quán)�����;或者核心技術(shù)發(fā)明專利的申請已由國務院專利行政部門公開。
2.產(chǎn)品主要工作原理/作用機理為國內(nèi)首創(chuàng)����,產(chǎn)品性能或者安全性與同類產(chǎn)品比較有根本性改進,技術(shù)上處于國際領(lǐng)先水平��,并且具有顯著的臨床應用價值。
3.申請人已完成產(chǎn)品的前期研究并具有基本定型產(chǎn)品�,研究過程真實和受控��,研究數(shù)據(jù)完整和可溯源�。
以上3條要求是浙江省申請創(chuàng)新醫(yī)療器械的基本要求。