第二類體外診斷試劑變更注冊常見發(fā)補問題
發(fā)布日期:2023-06-13 19:37瀏覽次數(shù):731次
寫有關(guān)醫(yī)療器械變更注冊事項的文章比較多����,以為體外診斷試劑相對常規(guī)器械更加穩(wěn)定,較少寫有關(guān)體外診斷試劑變更注冊這個話題�。本文帶大家一起了解第二類體外診斷試劑變更注冊常見發(fā)補問題���。
寫有關(guān)醫(yī)療器械變更注冊事項的文章比較多,以為體外診斷試劑相對常規(guī)器械更加穩(wěn)定�����,較少寫有關(guān)體外診斷試劑變更注冊這個話題�����。本文帶大家一起了解第二類體外診斷試劑變更注冊常見發(fā)補問題�����。
第二類體外診斷試劑變更注冊常見發(fā)補問題:
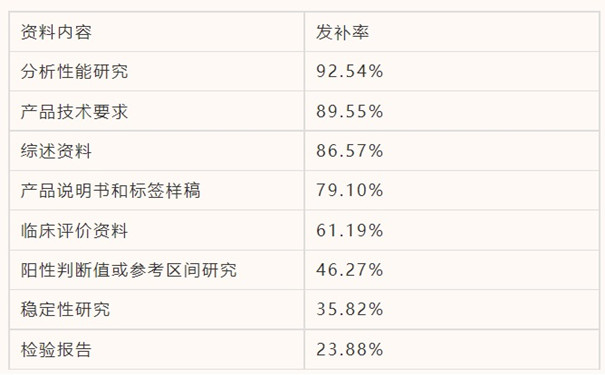
體外診斷試劑變更注冊最常見發(fā)補問題是對變更內(nèi)容的驗證和確認不夠充分���,或表述不規(guī)范。大部分問題與前文首次注冊常見問題相同��,不再贅述�����。另有一些注冊變更時需特別注意的問題有:性能指標變更中���,未提供變更指標在已獲批適用機型上的驗證資料����;未提供多批性能驗證資料。檢驗方法變更中�,未提供相關(guān)驗證資料;未說明變更方法的科學和理性����。參考區(qū)間變更中,未對變更人群區(qū)間進行說明或驗證��。產(chǎn)品技術(shù)要求變更中����,變更申請項目描述不規(guī)范;變更后的產(chǎn)品技術(shù)要求的性能指標和檢驗方法未體現(xiàn)符合國家標準品的要求���。適用儀器變更中�,未提供新增機型的注冊證信息�����。除此之外��,部分變更申報資料的風險分析報告中未對變更內(nèi)容進行風險分析,不能從產(chǎn)品的預期用途和與安全性等方面�,分析并識別變更的情況對于產(chǎn)品風險狀態(tài)的影響;還有一些申報資料的變更內(nèi)容未在關(guān)聯(lián)項目(如技術(shù)要求和說明書)中進行同步修正��。