根據(jù)《醫(yī)療器械注冊管理辦法》第三十五條及《體外診斷試劑注冊管理辦法》第四十五條的相關(guān)規(guī)定����,技術(shù)審評過程中,需要申請人補正資料的�,提交補充資料的時限為1年。
根據(jù)《醫(yī)療器械注冊管理辦法》第三十五條及《體外診斷試劑注冊管理辦法》第四十五條的相關(guān)規(guī)定����,技術(shù)審評過程中,需要申請人補正資料的����,提交補充資料的時限為1年。申請人逾期未提交補充資料的����,由技術(shù)審評機構(gòu)終止技術(shù)審評�,提出不予注冊的建議���,由食品藥品監(jiān)督管理部門核準(zhǔn)后作出不予注冊的決定���。
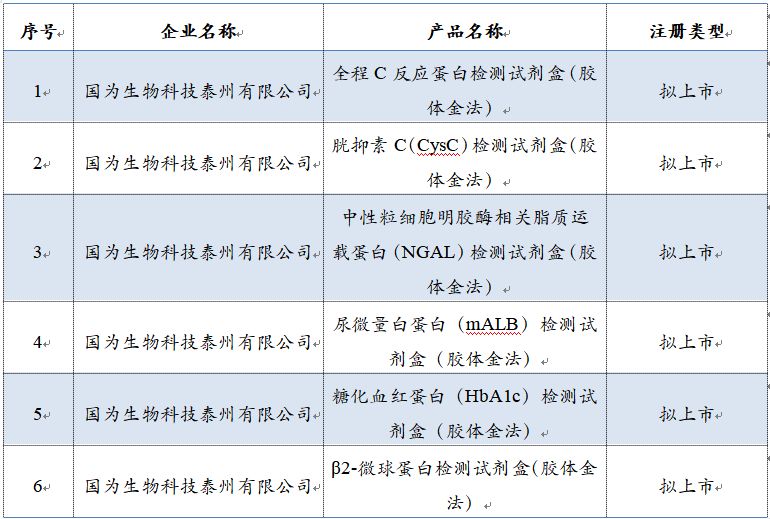
經(jīng)清理核實,截止2019年5月27日����,以下 6個產(chǎn)品(含擬上市注冊產(chǎn)品)仍未按規(guī)定提交補充資料,時間已經(jīng)超過1年�����,我中心擬終止技術(shù)審評���,提出不予注冊的建議��,上報江蘇省藥品監(jiān)督管理局(產(chǎn)品清單見附件)���。
附件:擬終止技術(shù)審評產(chǎn)品清單
江蘇省食品藥品監(jiān)督管理局認(rèn)證審評中心
2019年5月27日
附件:擬終止技術(shù)審評產(chǎn)品清單