摘要:我國醫(yī)療器械法規(guī)體系的構(gòu)建始于2000年《醫(yī)療器械管理條例》的實施��,經(jīng)過2014年��、2017年的2次修訂后�����,法規(guī)體系的框架已經(jīng)基本確立��。國家對于醫(yī)療器械有著嚴(yán)格的分類��,其中最高級別的第三類高風(fēng)險醫(yī)療器械對人體具有較大的潛在危險�,必須對其進行嚴(yán)格的準(zhǔn)入控制��,因此臨床試驗審批也是較為嚴(yán)格,下面是第三類高風(fēng)險醫(yī)療器械臨床試驗審批服務(wù)指南���,供大家參考���。
一、辦理流程
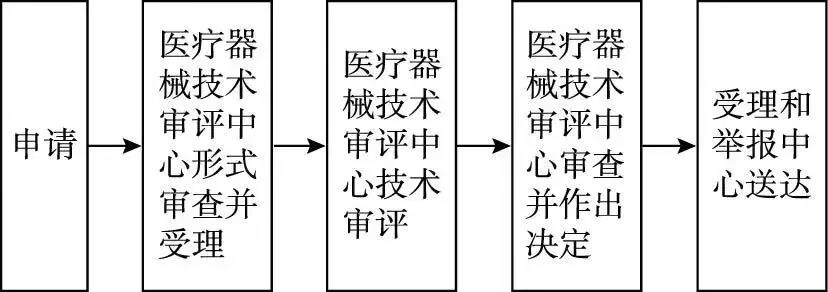
1.受理
申請人按照本《指南》第八條要求����,向國家藥品監(jiān)督管理局行政受理服務(wù)大廳提出申請,受理人員按照《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式的公告》(2014 年第 43 號)的要求對申報資 料進行形式審查�。
申請事項屬于本部門職權(quán)范圍,申報資料齊全�、符合形式審查要求的,予以受理;申報資料存在可以當(dāng)場更正的錯誤的����,允許申請人當(dāng)場更正;申報資料不齊全或者不符合形式審查要求的,在 5 個工作日內(nèi)一次告知申請人需要補正的全部內(nèi)容���,逾期不告知的����,自收到申報資料之日起即為受理;申請事項不屬于本部門職權(quán)范圍的,即時告知申請人不予受理����。
2.審查
受理人員自受理之日起 3 個工作日內(nèi)將申報資料轉(zhuǎn)交技術(shù)審評機構(gòu)。
技術(shù)審評機構(gòu)應(yīng)當(dāng)在 40 個工作日內(nèi)完 成技術(shù)審評工作��。
3.許可決定
國家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評中心應(yīng)當(dāng)在技術(shù)審評結(jié)束后 20 個工作日內(nèi)作出決定���。準(zhǔn)予開展臨床試驗的�,發(fā)給醫(yī)療器械臨床試驗批件;不予批準(zhǔn)的�����,應(yīng)當(dāng)書面說明理由����;自醫(yī)療器械臨床試驗審批申請受理并繳費之日起60個工作日內(nèi),未收到器審中心意見的���,可開展臨床試驗�。
(一)依據(jù)《中華人民共和國行政許可法》��,申請人依法享有以下權(quán)利:
1.依法取得行政許可的平等權(quán)利;
2.對行政機關(guān)實施行政許可��,享有陳述權(quán)��、申辯權(quán);
3.依法申請行政復(fù)議或者提起行政訴訟;
4.合法權(quán)益因行政機關(guān)違法實施行政許可受到損害的���,有權(quán)依法要求賠償。
(二)依據(jù)《醫(yī)療器械注冊管理辦法》 第三十六條��,受理注冊申請的藥品監(jiān)督管理部門對不予注冊的�����,應(yīng)當(dāng)書面說明理由�,并同時告知申請人享有申請復(fù)審和依法申請行政復(fù)議或者提起行政訴訟的權(quán)利。
(三)依據(jù)《中華人民共和國行政許可法》���、《醫(yī)療器械注冊管理辦法》等�����,申請人應(yīng)履行以下義務(wù):
1.對申請材料實質(zhì)內(nèi)容的真實性負(fù)責(zé);
2.依法開展取得行政許可的活動;
3.如實向負(fù)責(zé)監(jiān)督檢查的行政機關(guān)提供有關(guān)情況和材料�����。