醫(yī)療器械臨床試驗(yàn)稽查分為項(xiàng)目稽查�����、系統(tǒng)稽查����、供應(yīng)商稽查(比如:CRO公司選擇、中心實(shí)驗(yàn)室選擇等)�����,一般情況下針對臨床試驗(yàn)機(jī)構(gòu)的項(xiàng)目稽查居多�。政策和執(zhí)法尺度不斷在變化,項(xiàng)目稽查可以從臨床試驗(yàn)中機(jī)構(gòu)選擇�����、臨床試驗(yàn)操作到臨床試驗(yàn)結(jié)束貫穿整個(gè)臨床試驗(yàn)的全部過程�,依照現(xiàn)行法規(guī)對臨床試驗(yàn)項(xiàng)目進(jìn)行全方位的稽查。
醫(yī)療器械臨床試驗(yàn)稽查分為項(xiàng)目稽查���、系統(tǒng)稽查�����、供應(yīng)商稽查(比如:CRO公司選擇�、中心實(shí)驗(yàn)室選擇等)�,一般情況下針對臨床試驗(yàn)機(jī)構(gòu)的項(xiàng)目稽查居多。政策和執(zhí)法尺度不斷在變化����,項(xiàng)目稽查可以從臨床試驗(yàn)中機(jī)構(gòu)選擇�����、臨床試驗(yàn)操作到臨床試驗(yàn)結(jié)束貫穿整個(gè)臨床試驗(yàn)的全部過程��,依照現(xiàn)行法規(guī)對臨床試驗(yàn)項(xiàng)目進(jìn)行全方位的稽查��。
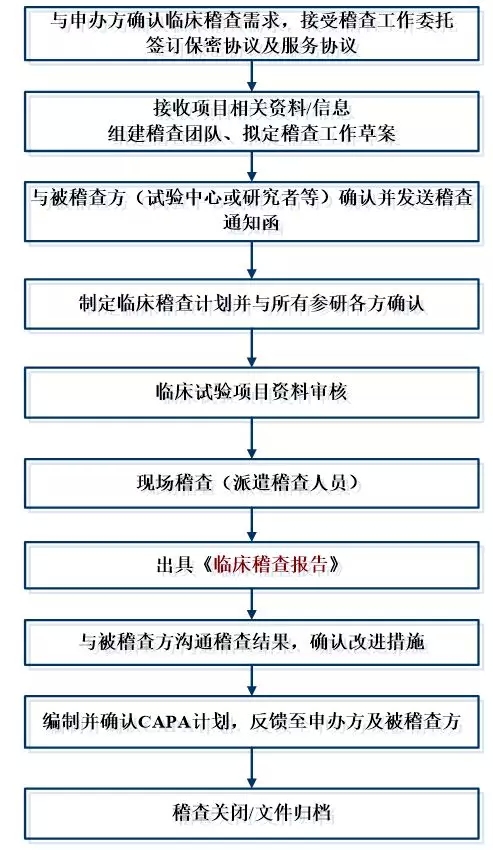
醫(yī)療器械臨床試驗(yàn)稽查一般流程如下:
1�����、企業(yè)委托第三方稽查公司���,簽訂稽查協(xié)議。
2��、第三方稽查公司接收臨床試驗(yàn)項(xiàng)目相關(guān)資料����,包括但不限于臨床試驗(yàn)方案、ICF����、CRF、原始記錄等相關(guān)文件����。
3、企業(yè)和第三方稽查公司共同確定被稽查的臨床試驗(yàn)機(jī)構(gòu)和稽查時(shí)間�。
4、第三方稽查公司組建稽查團(tuán)隊(duì)���,制訂稽查方案��、稽查記錄表格等���。
5、企業(yè)向被稽查的機(jī)構(gòu)提出稽查申請����,發(fā)出稽查函,獲得機(jī)構(gòu)批準(zhǔn)�����。
6�、第三方稽查公司在臨床試驗(yàn)機(jī)構(gòu)召開稽查啟動(dòng)會,向臨床試驗(yàn)機(jī)構(gòu)的有關(guān)人員介紹本次稽查的目的、內(nèi)容和程序���,并請主要研究者介紹臨床試驗(yàn)的有關(guān)情況��。
7�����、請求研究者的協(xié)助����,請其向相關(guān)輔助科室發(fā)出稽查通知�����,獲得輔助科室的配合����。
8、派遣稽查人員進(jìn)駐臨床試驗(yàn)機(jī)構(gòu)進(jìn)行現(xiàn)場稽查��,對研究者文件夾��、知情同意書�、原始文件/病例報(bào)告表�����、機(jī)構(gòu)HIS����、LIS系統(tǒng)等進(jìn)行稽查�����。
9�����、根據(jù)發(fā)現(xiàn)的問題提出建議并分別與研究者���、機(jī)構(gòu)老師確認(rèn)并溝通解決辦法。
10���、整理稽查記錄及問題�����,完成稽查報(bào)告��。
11���、與申辦方溝通����,完成整改報(bào)告���。
醫(yī)療器械臨床試驗(yàn)稽查流程圖: