CE認(rèn)證是歐盟的產(chǎn)品安全認(rèn)證��,所有進(jìn)入歐盟市場(chǎng)的醫(yī)療器械都必須進(jìn)行醫(yī)療器械CE認(rèn)證���,醫(yī)療器械需要滿足的CE指令有《有源植入性醫(yī)療器械指令》(AIMDD, 90/385/EEC)、《醫(yī)療器械指令》(MDD,93/42/EEC)和《體外診斷器械指令》(IVDD, 98/79/EC)����。
CE認(rèn)證是歐盟的產(chǎn)品安全認(rèn)證,所有進(jìn)入歐盟市場(chǎng)的醫(yī)療器械都必須進(jìn)行醫(yī)療器械CE認(rèn)證��,醫(yī)療器械需要滿足的CE指令有《有源植入性醫(yī)療器械指令》(AIMDD, 90/385/EEC)、《醫(yī)療器械指令》(MDD,93/42/EEC)和《體外診斷器械指令》(IVDD, 98/79/EC)��。
一�����、CE認(rèn)證簡(jiǎn)介
CE認(rèn)證是一種安全認(rèn)證標(biāo)志��,是產(chǎn)品進(jìn)入歐盟境內(nèi)銷售的通行證�。
在歐盟市場(chǎng)“CE”認(rèn)證屬強(qiáng)制性認(rèn)證標(biāo)志。
CE由法語“CommunateEuroppene”縮寫而成��,是歐洲共同體的意思�����。
歐洲共同體后來演變成了歐洲聯(lián)盟EU(簡(jiǎn)稱歐盟)��。
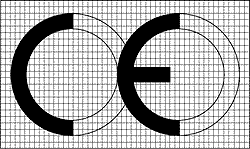

CE標(biāo)記是法律標(biāo)記�����,可以按一定比例放大和縮小�����。也可以看成是兩個(gè)相交的圓,兩個(gè)字母是等高的���,字母“E”中間的一劃要比上下兩筆略短少許����。CE標(biāo)記高度不能低于5mm�。
二、醫(yī)療器械指令簡(jiǎn)介
適用于心臟起搏器���、可植入的胰島素泵等�����,已于1993年1月1日生效,1995年1月1日強(qiáng)制實(shí)施�����。
已于1995年1月1日生效����,1998年6月14日強(qiáng)制實(shí)施,目前已升版為2007/47/EC。
適用于血細(xì)胞計(jì)數(shù)器����、妊娠檢測(cè)裝置等,已于1998年12月7日生效�,2003年12月7日強(qiáng)制實(shí)施。
三���、93/42/EEC中的定義�����、范圍
——疾病的診斷���、預(yù)防、監(jiān)視�、治療或減輕
——損傷或殘障的診斷、監(jiān)視�、治療、減輕或修補(bǔ)
——解剖學(xué)和生理過程的探查�����、替換或變更
——妊娠的控制
醫(yī)療器械不是通過藥理學(xué)�、免疫學(xué)或代謝學(xué)作用等方式在人體內(nèi)或人體上達(dá)到其預(yù)定的主要作用,但這些方式有助于其他功能的實(shí)現(xiàn)�����。
附件:本身雖然不是器械�,但由其制造商專門指定與器械一起使用�,使其能夠按照制造商預(yù)定的器械用途來使用
制造商:是指在以其名義將器械投放市場(chǎng)前負(fù)責(zé)器械的設(shè)計(jì)��、制造�����、包裝和標(biāo)簽的自然人或法人�,無論這些工作是自己完成的,還是由第三方代表他完成的���。
預(yù)期用途:是指根據(jù)制造商在標(biāo)簽�、說明書和或宣傳材料中提供的資料對(duì)器械預(yù)期的用途�。
四�、基本框架
MDD93/42/EEC指令共有23條款和12附錄��。其重點(diǎn)包括:
條款 1.本指令適用于醫(yī)療器械及其附件�����。
條款 2.成員國必須保證醫(yī)療器械只有在保證人身安全和健康時(shí)才能被投放市場(chǎng)和投入使用��。
條款 3.能保證安全和健康的器械是指滿足附錄I中基本要求的器械。
條款 4.帶有CE標(biāo)識(shí)的醫(yī)療器械可以在歐盟市場(chǎng)自由流通�。特殊用途的器械不應(yīng)加貼CE標(biāo)志:做臨床試驗(yàn)的器械和定制器械。
條款 5.符合協(xié)調(diào)標(biāo)準(zhǔn)的醫(yī)療器械被認(rèn)為滿足基本要求。
條款 8.如果發(fā)現(xiàn)器械不安全的話�����,保護(hù)條款允許某個(gè)成員國采取行動(dòng)��,召回已上市產(chǎn)品�,或禁止�、限制其投放市場(chǎng)�。
條款 9.依據(jù)附錄IX進(jìn)行分類�,分為I���、IIa���、IIb����、III類。
條款 10.上市后事故報(bào)告的要求,執(zhí)業(yè)醫(yī)師和醫(yī)療機(jī)構(gòu)�,制造商和歐盟代表都應(yīng)向主管當(dāng)局報(bào)告��。
條款 11.醫(yī)療器械必須經(jīng)過某一程序(附錄II—VII)以證明其滿足基本要求�����。
條款 12.有關(guān)系統(tǒng)和打包的醫(yī)療器械上市的特殊程序
條款 14.負(fù)責(zé)將器械投放市場(chǎng)的人員注冊(cè)��,歐盟數(shù)據(jù)庫
條款 15.臨床試驗(yàn):參照附錄X
條款 17.符合基本要求并通過了相應(yīng)的符合性評(píng)價(jià)程序的醫(yī)療器械必須帶有CE標(biāo)志���,參照附錄XII
五、附 錄
六�����、產(chǎn)品分類
分類規(guī)則的應(yīng)用由器械的預(yù)期用途決定
如果器械是和其他器械配合使用, 分類規(guī)則分別適用于每種器械附件
可以和其他一起使用的器械分開獨(dú)自分類
啟動(dòng)或影響某種器械的軟件與器械本身屬于同一類型,獨(dú)立的軟件屬于有源醫(yī)療器械
如果幾條規(guī)則適用于同一器械,以及這些規(guī)則的應(yīng)用會(huì)導(dǎo)致不同的分類標(biāo)準(zhǔn),則規(guī)則適用于導(dǎo)致最高分類級(jí)別
特別規(guī)則(規(guī)則13-18)優(yōu)先于其他規(guī)則
時(shí)間:暫時(shí)(<60分鐘)
短期(<30天)
長(zhǎng)期(>30天)
創(chuàng)傷性:非創(chuàng)傷 通過人體孔徑插入
外科創(chuàng)傷 植入
適用位置: 中央循環(huán)系統(tǒng)
中樞神經(jīng)系統(tǒng)
人體孔徑
其他地方
能量供應(yīng):無源 有源
規(guī)則1---8. 無源醫(yī)療器械的分類
規(guī)則9---12. 有源醫(yī)療器械的分類
規(guī)則13---18.特殊醫(yī)療器械的分類
規(guī)則1~4. 所有非創(chuàng)傷性器械均屬I類�,除非它們:
用于存儲(chǔ)體液(血袋例外) | IIa類 |
與IIa或更高類型的有源醫(yī)療器械連接使用 | IIa類 |
改變體液成分 | IIa/IIb類 |
一些傷口敷料 | IIa/IIb類 |
規(guī)則5. 侵入人體孔徑的醫(yī)療器械(不與有源醫(yī)療器械相連或僅與I類有源器械相連接)
暫時(shí)使用(例如:牙科診斷和治療時(shí)使用的手持鏡����、牙科加壓材料��、胃減壓管����、灌腸器械、檢查手套) | I類 |
短期使用(例如:氣管導(dǎo)管���、矯正隱形眼鏡�����、導(dǎo)尿管) | IIa類 |
長(zhǎng)期使用(例如:矯正隱形眼鏡���、導(dǎo)尿管) | IIb類 |
規(guī)則6. 外科創(chuàng)傷性器械暫時(shí)使用(如縫合針)��,屬IIa類���,以下情況除外:
可重復(fù)使用的外科器械(例如:鉗子、斧子) | I類 |
與中央循環(huán)系統(tǒng)或中樞神經(jīng)系統(tǒng)接觸的器械 | III類 |
可以被吸收的 | IIb類 |
與有源器械連接向人體發(fā)送能量或藥物 | IIb類 |
規(guī)則7.外科創(chuàng)傷性器械短期使用�,屬IIa類�,以下情況除外
與中央循環(huán)系統(tǒng)或中樞神經(jīng)系統(tǒng)接觸的器械 | III類 |
產(chǎn)生生物學(xué)影響或可以被吸收的 | III類 |
與有源器械連接向人體發(fā)送能力或藥物 | IIb類 |
規(guī)則8.外科創(chuàng)傷性器械長(zhǎng)期使用(接骨板��、眼內(nèi)晶體) IIb類�,以下情況除外
安裝在牙齒上的器械 | IIa類 |
與中央循環(huán)系統(tǒng)或中樞神經(jīng)系統(tǒng)接觸的器械 | III類 |
可以被吸收的 | III類 |
向人體給藥物裝置 | III類 |
2003/12/EC乳房植入 | III類 |
2005/50/EC髖關(guān)節(jié),膝關(guān)節(jié)��,肩關(guān)節(jié) | III類 |
規(guī)則9.用于施藥或換能的有源治療器械
給予或交換能量的有源治療器械,(例如:肌肉刺激器�����、電鉆���、皮膚光療機(jī)��、助聽器�、理療超聲設(shè)備) | IIa類 |
以一種潛在的危險(xiǎn)方式工作的(例如:嬰兒保溫箱����、高頻電刀、超聲碎石器�、外科激光器��、X光機(jī)) | IIb類 |
規(guī)則10.診斷用的有源器械
提供能量(例如:核磁共振��、超聲診斷儀) | IIa類 |
診斷/監(jiān)視體內(nèi)放射藥物分布(例如:r照相機(jī)����、正電子發(fā)射成像儀) | IIa類 |
診斷/監(jiān)視生理功能(例如:心電圖、腦電圖) | IIa類 |
危險(xiǎn)情況下監(jiān)視生理功能(例如:手術(shù)中的血?dú)夥治鰞x) | IIb類 |
發(fā)出發(fā)射電離輻射(例如:X射線診斷儀) | IIb類 |
規(guī)則11.控制藥物或其物質(zhì)進(jìn)出人體的有源器械屬于IIa類
如以一種潛在的危險(xiǎn)方式工作(例如:麻醉機(jī)���、透析機(jī)����、高壓氧艙) | IIb類 |
規(guī)則12.所有其他有源醫(yī)療器械屬于I類
(例如:觀察燈、牙科椅�����、輪椅��、牙科用治療燈���、記錄處理觀察診斷圖像用的有源器械)
規(guī)則13.與藥品或血液制品結(jié)合的器械
(例如:含殺精子的避孕套�����、含抗生素的牙髓材料)屬于III類
規(guī)則14.避孕用具
避孕套��、子宮帽 | IIb類 |
子宮內(nèi)避孕器 | III類 |
規(guī)則15.清洗或消毒的器械
醫(yī)療器械 | IIa類 |
侵入或創(chuàng)傷醫(yī)療器械(例如:內(nèi)窺鏡消毒) | IIb類 |
接觸鏡(例如:消毒液�����、護(hù)理液) | IIb類 |
規(guī)則16. 用于記錄X射線圖像的器械(例如:X光片��、熒光盤)屬于IIa類
規(guī)則17. 利用動(dòng)物組織或衍生物的器械(例如:生物心臟瓣膜��、腸線����、膠原)屬于III類
規(guī)則18. 血袋屬于IIb類
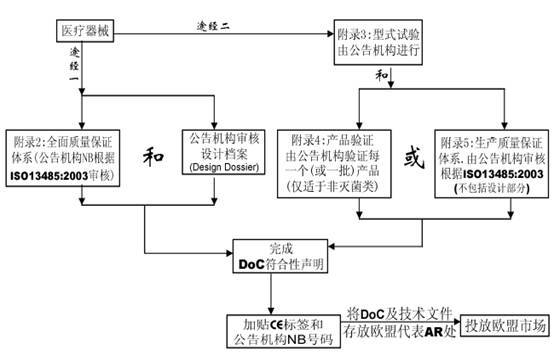
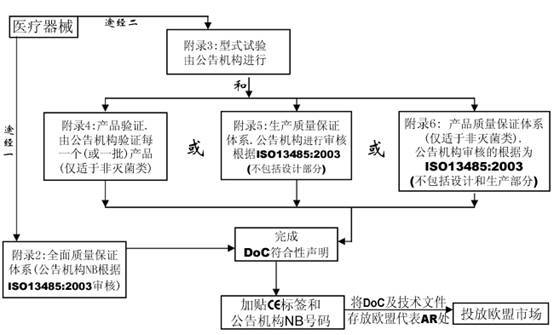
七、合格評(píng)定程序
在MDD指令中共有7個(gè)合格評(píng)定程序����,用于該指令條款11中規(guī)定的各類器械的合格評(píng)定。
附錄2 EC符合性聲明—全面質(zhì)量保證體系(常用的符合方式)
附錄3 EC產(chǎn)品型式檢驗(yàn)
附錄4 EC產(chǎn)品驗(yàn)證
附錄5 EC符合性聲明—生產(chǎn)質(zhì)量保證體系
附錄6 EC符合性聲明—產(chǎn)品質(zhì)量保證體系
附錄7 EC符合性聲明—自我符合性聲明
? 附錄8 特殊用途的器械聲明
附錄2 EC符合性聲明—全面質(zhì)量保證體系(常用的符合方式)
該全面質(zhì)量保證體系包括產(chǎn)品的設(shè)計(jì)和生產(chǎn)�����。它可用于除I類產(chǎn)品外的所有其他產(chǎn)品的合格評(píng)定�����。對(duì)于III類產(chǎn)品���,設(shè)計(jì)文檔檢查和該附錄條款4中的認(rèn)證是必須的���,對(duì)于IIa類產(chǎn)品,無需設(shè)計(jì)文檔檢查����。
附錄3 EC產(chǎn)品型式檢驗(yàn)
該附錄描述了產(chǎn)品型式試驗(yàn)的程序��,即制造商向公告機(jī)構(gòu)遞交完整的產(chǎn)品技術(shù)文檔以及產(chǎn)品的代表性樣品����。公告機(jī)構(gòu)檢查產(chǎn)品是否與技術(shù)文檔一致�����,并是否符合基本要求��,如需要?jiǎng)t進(jìn)行這方面的測(cè)試�,EC型式檢驗(yàn)證書。該附錄僅包括器械的設(shè)計(jì)��,并適用于IIb或III類醫(yī)療器械����。
附錄4 EC產(chǎn)品驗(yàn)證
該EC產(chǎn)品驗(yàn)證程序確保器械依據(jù)一個(gè)認(rèn)可的型號(hào)或技術(shù)文件中描述的器械生產(chǎn)。在該程序下��,公告機(jī)構(gòu)檢查每個(gè)或多個(gè)樣品并進(jìn)行試驗(yàn)以證明產(chǎn)品是否符合已認(rèn)可文件化的設(shè)計(jì)���。該程序不適用于無菌醫(yī)療器械�。
附錄5 EC合格聲明—生產(chǎn)質(zhì)量保證體系
該附錄描述了一個(gè)生產(chǎn)質(zhì)量保證體系,即由公告機(jī)構(gòu)證明該體系能保證器械能夠依據(jù)認(rèn)可的型號(hào)���,或依據(jù)技術(shù)文件中描述的器械生產(chǎn)���。該附錄適用于IIa, IIb和III類器械。
附錄6 EC合格聲明—產(chǎn)品質(zhì)量保證體系
該附錄描述了一個(gè)質(zhì)量體系����,該體系通過產(chǎn)品的最終檢驗(yàn)和試驗(yàn)以確保生產(chǎn)的器械符合已認(rèn)可的型號(hào),或技術(shù)文件中規(guī)定的器械�。該附錄適用于IIa和IIb類器械。該程序不適用于無菌類醫(yī)療器械���。
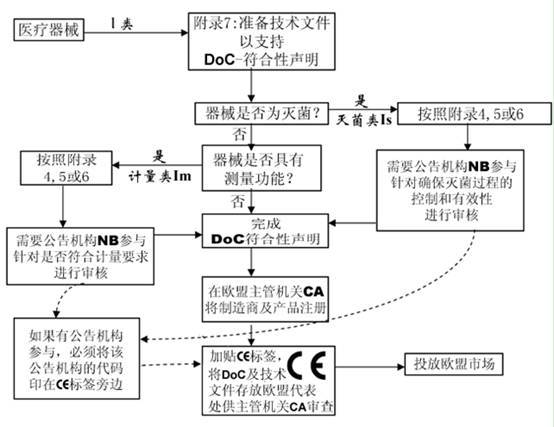
附錄7 EC合格聲明—自我符合性聲明
該附錄描述制造商必須準(zhǔn)備技術(shù)文件以支持某類醫(yī)療器械的合格聲明���,這里無需公告機(jī)構(gòu)介入。該附錄適用于I和IIa類器械�����。
附錄8 特殊用途的器械聲明
該附錄描述對(duì)于定制器械和臨床調(diào)查類器械�����,制造商必須準(zhǔn)備技術(shù)文件以支持醫(yī)療器械的合格聲明���,這里無需公告機(jī)構(gòu)介入�����。
八��、CE認(rèn)證的基本流程
1.分析該器械的特點(diǎn)���,確定它是否在指令范圍內(nèi)
2.確定該器械的分類類別
3.確認(rèn)適用的基本要求/有關(guān)的協(xié)調(diào)標(biāo)準(zhǔn)
4.確認(rèn)該器械滿足基本要求/協(xié)調(diào)標(biāo)準(zhǔn),并使證據(jù)文件化(技術(shù)文檔的整理)
5.確定相應(yīng)的符合性評(píng)價(jià)程序
6.對(duì)于IIa類或更高類型器械��,以及I類無菌或測(cè)量器械��,應(yīng)通過公告機(jī)構(gòu)并進(jìn)行符合性評(píng)價(jià)程序
7.起草符合性聲明并加貼CE標(biāo)志
I 類
IIa 類
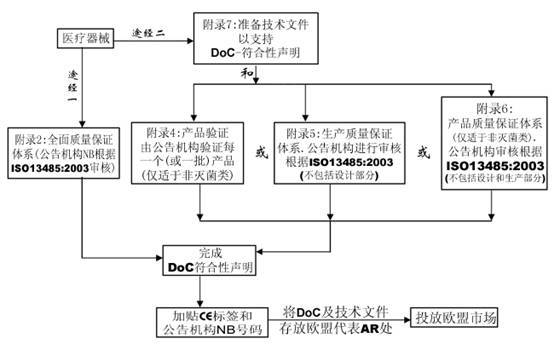
IIb 類
III 類