2024年2月5日��,國(guó)家藥監(jiān)局發(fā)布《2023年度醫(yī)療器械注冊(cè)工作報(bào)告》�,為大家介紹了2023年全年我國(guó)醫(yī)療器械注冊(cè)總體情況,一起看正文�����。
2024年2月5日,國(guó)家藥監(jiān)局發(fā)布《2023年度醫(yī)療器械注冊(cè)工作報(bào)告》�����,為大家介紹了2023年全年我國(guó)醫(yī)療器械注冊(cè)總體情況�����,一起看正文�����。
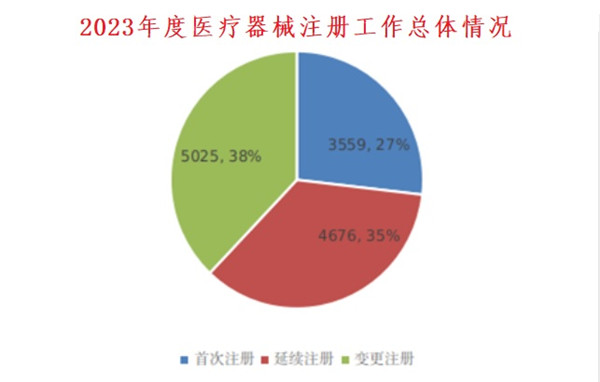
2023年度醫(yī)療器械注冊(cè)總體情況
(一)醫(yī)療器械監(jiān)管法規(guī)制度體系更加完善��。2023年9月8日�,十四屆全國(guó)人大常委會(huì)將《醫(yī)療器械管理法》列入立法規(guī)劃項(xiàng)目,國(guó)家藥監(jiān)局已成立工作領(lǐng)導(dǎo)小組��、工作組����、專家咨詢組,著手起草相關(guān)法律文本����。會(huì)同國(guó)家衛(wèi)生健康委����、國(guó)家疾控局聯(lián)合印發(fā)《醫(yī)療器械緊急使用管理規(guī)定(試行)》�,為醫(yī)療器械緊急使用提供法律支撐。起草《醫(yī)療機(jī)構(gòu)臨床急需醫(yī)療器械臨時(shí)進(jìn)口使用管理要求》���。
(二)創(chuàng)新醫(yī)療器械質(zhì)量數(shù)量實(shí)現(xiàn)雙豐收��。2023年�����,國(guó)家藥監(jiān)局共批準(zhǔn)創(chuàng)新醫(yī)療器械61個(gè),優(yōu)先審批醫(yī)療器械12個(gè)����,創(chuàng)新醫(yī)療器械批準(zhǔn)數(shù)量再創(chuàng)新高,比2022年增加6個(gè)�����。在數(shù)量增加的同時(shí)���,創(chuàng)新醫(yī)療器械“含金量”不斷提升��,在全球率先批準(zhǔn)通過破壞交感神經(jīng)治療肺動(dòng)脈高壓的一次性使用環(huán)形肺動(dòng)脈射頻消融導(dǎo)管上市��,單光子發(fā)射及X射線計(jì)算機(jī)斷層成像系統(tǒng)���、腹腔內(nèi)窺鏡單孔手術(shù)系統(tǒng)���、顱內(nèi)取栓支架等產(chǎn)品技術(shù)達(dá)到國(guó)際領(lǐng)先水平,更好地滿足了公眾使用高端醫(yī)療器械的需求����。
(三)服務(wù)國(guó)家重大戰(zhàn)略穩(wěn)步實(shí)施。大力支持京津冀�、長(zhǎng)三角、粵港澳大灣區(qū)�、海南自貿(mào)港、福建等重點(diǎn)區(qū)域建設(shè)���。批準(zhǔn)人工耳蝸聲音處理器等3個(gè)海南臨床真實(shí)世界應(yīng)用試點(diǎn)產(chǎn)品上市�,截至目前�,累計(jì)批準(zhǔn)產(chǎn)品9個(gè),惠及更多患者����。指導(dǎo)召開第二屆博鰲國(guó)際藥械真實(shí)世界研究大會(huì)���。指導(dǎo)粵港澳大灣區(qū)使用20種、29批次港澳已上市的醫(yī)療器械��,服務(wù)區(qū)域診療需要��。設(shè)立醫(yī)療器械創(chuàng)新山東����、北京、河北���、湖北服務(wù)站��,創(chuàng)新服務(wù)站數(shù)量已達(dá)11個(gè)����,服務(wù)區(qū)域產(chǎn)業(yè)高質(zhì)量發(fā)展成效初步顯現(xiàn)���。推進(jìn)人工智能醫(yī)療器械、生物材料創(chuàng)新任務(wù)揭榜掛帥工作���,共遴選出48個(gè)人工智能醫(yī)療器械�����、40個(gè)生物材料揭榜項(xiàng)目�����?;I建高端醫(yī)療裝備創(chuàng)新合作平臺(tái),加速高端醫(yī)療器械創(chuàng)新轉(zhuǎn)化速度����。完善前置申請(qǐng)機(jī)制,加大前置審評(píng)輔導(dǎo)力度�����,9個(gè)產(chǎn)品通過輔導(dǎo)已申請(qǐng)注冊(cè)�����。
(四)常態(tài)化疫情防控保障有力���。應(yīng)急批準(zhǔn)廣東��、北京���、江蘇3家企業(yè)的3個(gè)國(guó)產(chǎn)體外膜肺氧合系統(tǒng)(ECMO)上市���,助力疫情防控“保健康、防重癥”目標(biāo)落實(shí)���。全年批準(zhǔn)新冠病毒檢測(cè)試劑21個(gè)�����,其中核酸檢測(cè)試劑9個(gè)���,抗原檢測(cè)試劑12個(gè)。截至目前累計(jì)批準(zhǔn)新冠病毒檢測(cè)試劑157個(gè)�,充分滿足疫情防控需要。協(xié)同國(guó)家衛(wèi)生健康委�、國(guó)家疾控局聯(lián)合推進(jìn)猴痘檢測(cè)試劑產(chǎn)品研發(fā)和產(chǎn)品注冊(cè)上市。持續(xù)做好新冠病毒變異株監(jiān)測(cè)和檢測(cè)試劑能力評(píng)估����,確保產(chǎn)品有效檢出能力。
(五)醫(yī)療器械注冊(cè)備案管理水平顯著提升���。部署各地開展第二類醫(yī)療器械注冊(cè)清理規(guī)范全面整改�����,召開全國(guó)第二類醫(yī)療器械注冊(cè)管理工作會(huì)議���,印發(fā)強(qiáng)化醫(yī)療器械注冊(cè)管理工作意見,部署全面加強(qiáng)注冊(cè)管理有關(guān)工作���。對(duì)一次性使用微波消融針�、重組膠原蛋白創(chuàng)面敷料等��,出臺(tái)相關(guān)文件和指導(dǎo)原則�,統(tǒng)一規(guī)范注冊(cè)工作要求。指導(dǎo)基層做好第一類醫(yī)療器械備案工作�。持續(xù)規(guī)范第一類產(chǎn)品備案,切實(shí)加強(qiáng)對(duì)市級(jí)監(jiān)管部門的監(jiān)督指導(dǎo)���。
(六)醫(yī)療器械臨床試驗(yàn)管理力度繼續(xù)加大�����。開展27個(gè)品種的臨床試驗(yàn)產(chǎn)品真實(shí)性核查��,31個(gè)品種的臨床試驗(yàn)監(jiān)督抽查�����,較2022年數(shù)量加倍�。發(fā)布監(jiān)督抽查情況通報(bào)一期,對(duì)存在問題的產(chǎn)品嚴(yán)肅處理���,作出不予注冊(cè)����、一年內(nèi)不予受理的決定�����。截至2023年底��,醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)備案數(shù)量達(dá)到1340家���,與2022年相比增加13.8%�。
(七)醫(yī)療器械標(biāo)準(zhǔn)質(zhì)量不斷提升�����。修訂發(fā)布《醫(yī)療器械標(biāo)準(zhǔn)報(bào)批發(fā)布工作細(xì)則》《醫(yī)療器械標(biāo)準(zhǔn)驗(yàn)證工作細(xì)則》�,制定《醫(yī)療器械標(biāo)準(zhǔn)實(shí)施評(píng)價(jià)工作細(xì)則》等文件,標(biāo)準(zhǔn)制修訂管理更加精細(xì)�。成立全國(guó)醫(yī)用防護(hù)標(biāo)準(zhǔn)化工作組及口腔數(shù)字化醫(yī)療器械、醫(yī)療器械可靠性與維修性等2個(gè)標(biāo)準(zhǔn)化技術(shù)歸口單位����。發(fā)布28項(xiàng)醫(yī)療器械國(guó)家標(biāo)準(zhǔn)、131項(xiàng)行業(yè)標(biāo)準(zhǔn)及14項(xiàng)行業(yè)標(biāo)準(zhǔn)修改單�����。截至2022年底����,現(xiàn)行有效醫(yī)療器械標(biāo)準(zhǔn)共1974項(xiàng),其中國(guó)家標(biāo)準(zhǔn)271項(xiàng)����,行業(yè)標(biāo)準(zhǔn)1703項(xiàng),與國(guó)際標(biāo)準(zhǔn)一致性程度超過90%�,標(biāo)準(zhǔn)體系覆蓋性、系統(tǒng)性不斷提升��。我國(guó)主導(dǎo)制定的ISO 24072《輸液器進(jìn)氣器件氣溶膠細(xì)菌截留試驗(yàn)方法》國(guó)際標(biāo)準(zhǔn)正式發(fā)布,2名中國(guó)專家當(dāng)選國(guó)際電工組織(IEC)技術(shù)委員會(huì)副主席和分技術(shù)委員會(huì)主席����,《人工智能醫(yī)療器械 肺部影像輔助分析軟件 算法性能測(cè)試方法》標(biāo)準(zhǔn)獲批國(guó)際標(biāo)準(zhǔn)立項(xiàng)。發(fā)布《國(guó)家藥品監(jiān)督管理局關(guān)于GB 9706.1-2020及配套并列標(biāo)準(zhǔn)��、專用標(biāo)準(zhǔn)實(shí)施有關(guān)工作的通告》及兩期解讀����,印發(fā)《GB 9706.1-2020標(biāo)準(zhǔn)檢驗(yàn)要點(diǎn)》,公開發(fā)布41個(gè)新版GB 9706系列標(biāo)準(zhǔn)的檢驗(yàn)報(bào)告模板���,建立專家咨詢機(jī)制����,有效推動(dòng)新版GB 9706系列標(biāo)準(zhǔn)的平穩(wěn)有序?qū)嵤?/span>
(八)醫(yī)療器械分類管理扎實(shí)推進(jìn)�����。發(fā)布《關(guān)于進(jìn)一步加強(qiáng)和完善醫(yī)療器械分類管理工作的意見》�,強(qiáng)化分類管理頂層設(shè)計(jì)。完成醫(yī)療器械分類技術(shù)委員會(huì)換屆工作�,修訂發(fā)布《醫(yī)療器械分類技術(shù)委員會(huì)工作規(guī)則》。動(dòng)態(tài)調(diào)整分類目錄����,發(fā)布《關(guān)于調(diào)整〈醫(yī)療器械分類目錄〉部分內(nèi)容的公告》�,涉及58個(gè)產(chǎn)品�。發(fā)布《重組膠原蛋白生物材料命名指導(dǎo)原則》解讀,進(jìn)一步指導(dǎo)和規(guī)范醫(yī)療器械領(lǐng)域重組膠原蛋白生物材料的命名�。組織成立中醫(yī)(民族醫(yī))器械專項(xiàng)工作小組��,統(tǒng)籌開展中醫(yī)(民族醫(yī))器械分類�、命名、標(biāo)準(zhǔn)�����、審評(píng)�、檢驗(yàn)、核查等工作����。
(九)醫(yī)療器械唯一標(biāo)識(shí)工作有序開展。開展唯一標(biāo)識(shí)第一批�����、第二批實(shí)施工作總結(jié)����,通報(bào)先進(jìn)經(jīng)驗(yàn)做法�����。發(fā)布《關(guān)于做好第三批實(shí)施醫(yī)療器械唯一標(biāo)識(shí)工作的公告》�����,將臨床需求量較大的一次性使用產(chǎn)品����、集中帶量采購(gòu)中選產(chǎn)品�、醫(yī)療美容相關(guān)產(chǎn)品等103種風(fēng)險(xiǎn)較高的第二類醫(yī)療器械納入第三批實(shí)施范圍。組建醫(yī)療器械唯一標(biāo)識(shí)專家咨詢團(tuán)隊(duì)�����,為深入推進(jìn)唯一標(biāo)識(shí)實(shí)施工作提供支撐�。制定《醫(yī)療器械唯一標(biāo)識(shí)的形式和內(nèi)容》《醫(yī)療器械唯一標(biāo)識(shí)的包裝實(shí)施和應(yīng)用》兩項(xiàng)醫(yī)療器械行業(yè)標(biāo)準(zhǔn),進(jìn)一步指導(dǎo)醫(yī)療器械唯一標(biāo)識(shí)工作實(shí)施����。
(十)監(jiān)管科學(xué)研究工作成果顯著。組織推進(jìn)第二批監(jiān)管科學(xué)6個(gè)重點(diǎn)項(xiàng)目13個(gè)醫(yī)療器械子項(xiàng)目工作,已形成醫(yī)療器械監(jiān)管新工具���、新標(biāo)準(zhǔn)����、新方法141項(xiàng)�。組織藥品監(jiān)管科學(xué)體系建設(shè)第一批重點(diǎn)項(xiàng)目醫(yī)療器械領(lǐng)域重點(diǎn)項(xiàng)目申請(qǐng)和遴選;啟動(dòng)新一代基因測(cè)序產(chǎn)品評(píng)價(jià)方法研究��、數(shù)字療法醫(yī)療器械質(zhì)量評(píng)價(jià)方法研究等9項(xiàng)重點(diǎn)項(xiàng)目��。配合開展監(jiān)管科學(xué)研究基地和重點(diǎn)實(shí)驗(yàn)室考核����,促進(jìn)研究質(zhì)量提升����。
(十一)醫(yī)療器械技術(shù)審查能力持續(xù)提升。技術(shù)審評(píng)質(zhì)量管理體系與業(yè)務(wù)工作高效融合��,審評(píng)質(zhì)量監(jiān)測(cè)���、運(yùn)行和改進(jìn)體系持續(xù)完善��。醫(yī)療器械注冊(cè)審評(píng)購(gòu)買服務(wù)工作穩(wěn)步實(shí)施��。長(zhǎng)三角��、大灣區(qū)審評(píng)分中心審評(píng)人員數(shù)量分別增加176%���、109%�����。全年發(fā)布67項(xiàng)指導(dǎo)原則和6項(xiàng)審評(píng)要點(diǎn)��,現(xiàn)行有效指導(dǎo)原則達(dá)到613項(xiàng)�,對(duì)醫(yī)療器械分類目錄覆蓋率達(dá)92.2%���。持續(xù)開展全系統(tǒng)醫(yī)療器械注冊(cè)管理實(shí)務(wù)培訓(xùn)����、充分發(fā)揮實(shí)訓(xùn)基地作用���,線上舉行12期省級(jí)醫(yī)療器械審評(píng)審批人員線上培訓(xùn)�,8300余人參訓(xùn)��,舉辦首次省級(jí)醫(yī)療器械審評(píng)員線下實(shí)地培訓(xùn),提升培訓(xùn)效果���。公開已發(fā)布的GB 9706相關(guān)醫(yī)療器械標(biāo)準(zhǔn)解讀視頻��,150余萬人次在線瀏覽學(xué)習(xí)��。